|
УДК 550.4:622.411.34/.622.324.6 |
Происхождение H2S и СО2 в углеводородных скоплениях (По изотопным данным.)
Р. Г. ПАНКИНА, В. Л. МЕХТИЕВА (ВНИГНИ)
Кислые компоненты являются обязательной составляющей углеводородных скоплений; количество их может колебаться от сотых долей до десятков процентов. Они, с одной стороны, нежелательные примеси (в особенности H2S), создающие большие сложности при разведке и эксплуатации месторождений, а с другой - могут служить источником дефицитного сырья.
Интерес к происхождению неуглеводородных компонентов возрастает в связи с обнаружением в ряде регионов Советского Союза - Прикаспийской впадине, Амударьинской синеклизе, Западно-Сибирской платформе залежей УВ с высокими концентрациями CO2 и H2S. Содержание кислых газов и динамика их концентрации тесным образом связаны с происхождением, которое, в свою очередь, находит отражение в изотопном составе слагающих эти газы элементов.
Нами в течение ряда лет проводились исследования изотопного состава (Далее в тексте и. с. сероводорода (или H2S) и углекислоты (или CO2).) серы сероводорода и углерода углекислоты (Определение и. с. углерода и серы проводилось на масс-спектрометре МИ-1305 с точностью до 0,4 ‰. И. с. выражен в значениях d13С и d34S, в ‰.) в подземных водах и газах нефтяных и газовых месторождений ряда нефтегазоносных регионов Советского Союза (Волго-Уральский, Таджикская депрессия, Северное Предкавказье, Амударьинская синеклиза, Прикаспийская впадина, Западная Сибирь). Для сопоставления определяли также и.с. серы нефтей, сульфатов вод и пород, углерода карбонатов, нефтей и РОВ. Изотопные данные затем были сопоставлены с количественным распределением CO2 и H2S, с результатами микробиологических исследований, а также с соответствующими геологогеохимическими материалами.
Несмотря на разнообразие геолого-геохимических условий исследованных территорий для них отмечены характерные соотношения между концентрацией кислых компонентов в газах, их изотопным составом, термобарическими условиями и некоторыми геологическими особенностями строения и развития регионов. Все исследованные газы по и. с. и концентрации можно разделить на две основные группы: одна - с низкими концентрациями H2S и CO2 (менее 2 и 5 % соответственно) (Граничные концентрации H2S и CO2 даны с известным приближением.), отличающаяся относительно легким и. с. серы и углерода и довольно широким разбросом значений d34S и d13С; другая - с высокими (более 2 и 5 %) концентрациями этих газов, характеризующаяся относительно тяжелым и. с. H2S и CO2 и незначительным разбросом d34S и d13С.
Сероводород из первой группы газов (концентрация H2S<3 %) обогащен легким изотопом 32S примерно на 15-20 ‰, а в отдельных случаях и выше (до 35-45 ‰) по отношению к сульфату вмещающих пород. Этот H2S образуется в зоне относительно невысоких температур (до 60-70 °С) в процессе бактериальной редукции сульфатов за счет окисления нефти, РОВ или водорастворенного ОВ. Легкий биогенный сероводород был обнаружен в месторождениях Самарской Луки (бобриковский горизонт, башкирский и кунгурский ярусы), в Сергиевских минеральных водах (спириферовый горизонт Калиновской свиты верхней перми), в месторождениях Таджикской депрессии (бухарские и алайские слои), в юрских отложениях Бухарской ступени, краевых частях Чарджоуской ступени и юго-западных отрогов Гиссара; в надсолевых образованиях Прикаспийской впадины; в меловых и третичных породах Северного Предкавказья [8]. Степень обогащения сероводорода легким изотопом серы варьирует в зависимости от конкретных условий формирования вод и в первую очередь от глубины развития процесса бактериальной редукции сульфатов. Для всех упомянутых территорий удалось однозначно доказать с помощью изотопных и микробиологических исследований современную бактериальную природу сероводорода.
Иногда, при невысоких концентрациях, биогенный H2S отличается утяжеленным и.с. Это наблюдается при интенсивной бактериальной сульфатредукции в пластовых водах, протекающей на фоне ограниченного количества сульфатов. В этом случае концентрация H2S определяется скоростью пополнения запасов водорастворенного сульфата, пластовые воды практически бессульфатны, а и.с. H2S и сульфата близок. Подобная ситуация складывается в бессульфатных нефтяных пластовых водах, содержащих H2S, а также в краевых водах нефтегазоносных бассейнов, обогащенных водорастворенным ОВ (Хоста, Мацеста) [4, 9].
Биогенный H2S, как правило, сопровождается изотопически легким CO2, так как оба этих газа образуются в эквимолярных концентрациях при восстановлении сульфатов ОВ по следующей схеме:
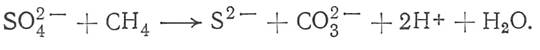
Обратная взаимосвязь отмечается далеко не всегда, так как CO2 образуется в значительных количествах при всех процессах деструкции ОВ как биогенных, так и абиогенных; возникновение H2S при этом возможно, но не обязательно. Кроме того, при дефиците сульфатов образующийся биогенный H2S будет изотопически утяжеленным, а CO2 - облегченным. Таким образом, можно говорить лишь о частичном парагенезисе легкоизотопных CO2 и H2S.
В первой группе газов значения d13С углекислоты в основном лежат в пределах от -17 до -25 ‰, что свидетельствует о ее генетической связи с УВ нефтей, с РОВ и водорастворенной органикой. Изотопно легкий CO2 был встречен в залежах бобриковского горизонта Среднего Поволжья, меловых отложений Предкавказья и в мезозойских породах Западной Сибири [2, 5].
Для высококонцентрированных кислых газов характерен тяжелый и. с. H2S и CO2. В крупных углеводородных скоплениях, содержащих высокие концентрации H2S (от 4 до 20 %), он имеет утяжеленный и. с. (Оренбургское, Уртабулакское, Денгизкуль-Хаузакское, Астраханское). В пластовых водах этих месторождений сульфатредуцирующие бактерии не обнаружены, сульфаты присутствуют в заметных, иногда даже больших, количествах, пластовые температуры (за исключением Оренбургского месторождения) (Оренбургское месторождение в этом плане представляется нетипичным; сероводород в нем, по всем признакам, миграционный из нижележащих отношений [8].) повышенные (от 75°С и выше). Для всех этих скоплений УВ, содержащих значительные концентрации сероводорода, характерно то, что они связаны с газоконденсатными залежами, имеющими нефтяную оторочку, приурочены к карбонатно-сульфатным комплексам, коллекторами служат карбонатные, зачастую рифогенные породы.
Сероводород таких скоплений по значениям d34S сходен с сульфатами отложений, в которых находятся залежи, иногда даже несколько обогащен 34S по сравнению с ними; указанные особенности и. с. серы присущи не только исследованным нами месторождениям, а, по-видимому, и другим крупным скоплениям сероводорода [3, 11]. Все вышеизложенное позволяет заключить, что источником серы в месторождениях с высоким содержанием H2S служат сульфаты вод и пород, о чем свидетельствует близость значений d34S сероводорода и эвапоритов.
Механизм образования изотопно тяжелого H2S в недрах до сих пор таит много загадок. Связь его с сульфатами вод и пород несомненна, о чем убедительно свидетельствует сходство их и. с.
Вопрос об абиогенном восстановлении сульфатов в земной коре подробно рассмотрен в работе [7]. Твердые сульфаты очень устойчивы к воздействию высоких температур и не разлагаются ниже 600-700 °С. Растворы их не вступают в реакцию с ОВ в интервале температур 200-300 °С.
Однако в присутствии сероводорода или иных восстановленных соединений серы сульфаты при этих (а возможно и несколько более низких) температурах легко окисляют широкую гамму ОВ, в том числе и УВ [12]. Логично допустить, что в условиях земных недр при температурах, превышающих 75 °С, в присутствии небольших количеств H2S или иных восстановленных соединений серы может происходить восстановление сульфатов в водной среде.
При химическом восстановлении сульфатов в условиях их избытка образующийся H2S обогащается легким изотопом 32S примерно на 20 ‰ за счет кинетического изотопного эффекта. При протекании этого процесса в условиях дефицита сульфата и. с. H2S и сульфата будут близки. По-видимому, восстановление сульфатов в недрах в условиях повышенных температур отвечает именно последнему варианту. По данным [6], концентрация сульфатов в растворе при выщелачивании пород возрастает с увеличением температуры до 100 °С и снижается в интервале температур от 150 до 200 С, что обусловлено уменьшением растворимости гипса. В интервале 100-200 °С восстановление сульфат-иона возможно, причем направленность процессов растворения сульфатов и скорости их восстановления противоположны. Если учесть, что процессы эти чаще всего протекают в метаморфизованных водах, обогащенных двухвалентными катионами и в силу этого неспособных содержать большие количества сульфат-иона, то высказанное предположение представляется достаточно обоснованным с точки зрения химии. С геологических позиций в его пользу говорят две характерные особенности территорий, на которых обнаружены крупные скопления H2S: первая - это высокие современные температуры недр (порядка 100 °С) и вторая - перерывы в осадконакоплении и выход (в геологическом прошлом) сероводородсодержащих отложений в зону гипергенеза [1].
В зоне гипергенеза в водах, содержащих SO42- и ОВ, как правило, развивается бактериальная редукция сульфатов, сопровождающаяся образованием H2S и сульфидов. При погружении таких отложений на большие глубины и соответственном повышении температуры процесс биогенной сульфатредукции постепенно может заменяться абиогенным восстановлением водорастворенного сульфата в присутствии H2S, служащего переносчиком электронов. Такой механизм образования больших скоплений H2S в настоящее время представляется наиболее вероятным для Астраханского свода и для территории Амударьинской синеклизы. Впрочем, для последней возможен и иной путь, а именно аккумуляция реликтового биогенного сероводорода в известковистых биогермных коллекторах совместно с мигрирующими углеводородными газами.
Происхождение углекислых струй многие исследователи связывают с поступлением ювенильной углекислоты. Иногда подобный генезис приписывают и повышенным концентрациям СO2 в углеводородных скоплениях. По другим представлениям, основным источником высоких концентраций СO2 в углеводородных залежах служат карбонатные породы [5, 11]. Углекислый газ, генетически связанный с карбонатами, близок к ним по значениям d13С и имеет утяжеленный и. с.
Газы с высокими концентрациями изотопически тяжелой углекислоты встречаются в областях широкого развития карбонатных пород, отличающихся повышенными (более 80 °С) температурами (Западное Предкавказье и Западно-Сибирская плита, Астраханский свод и т. д.), что свидетельствует о генетической их связи.
Из литературных данных известно, что сухие карбонатные породы отличаются большой устойчивостью по отношению к термическим воздействиям и не разлагаются при температурах ниже 500-600 °С. Эти температуры заведомо превышают границы, при которых возможно образование и существование углеводородных скоплений. Однако в присутствии воды карбонатные породы растворяются и диссоциируют, начиная с температуры 75 °С. Схематически реакция образования углекислоты в результате гидролиза кальцита выражается следующим уравнением:
![]()
Эксперименты, проведенные Н.Г. Кисейным и С.И. Пахомовым [6], свидетельствуют о возможности генерации значительных количеств углекислоты в результате воздействия воды на породы, содержащие карбонатное вещество, при температурах, совместимых с таковой при процессах нефтегазообразования. Из термодинамических расчетов и экспериментальных данных следует, что углекислота, образующаяся за счет диссоциации карбонатов, в основном должна наследовать изотопный состав их углерода. Изотопные эффекты как термодинамические, так и кинетические, в подавляющем большинстве случаев направлены на небольшое (порядка нескольких ‰) обогащение СO2 легким изотопом 12С. Максимальное обогащение при однократном процессе не превышает 15 ‰). Величина изотопного фракционирования углерода для системы СO2 - СаСO3 в интервале температур 100-180 °С, т. е. в условиях, благоприятных для гидролиза карбонатов, очень мала (103 lna от -4 до -0,4) [10]. Термодинамические параметры вполне применимы к геологическим ситуациям, встречающимся в недрах, а именно к случаям пребывания карбонатных пород в закрытых участках земной коры, отличающихся относительно застойным гидродинамическим режимом.
Помимо вышеупомянутых двух основных изотопных групп кислых газов существует и промежуточная, образующаяся за счет смешения газов различного генезиса. Это смешение может происходить как вследствие миграции газов из одних отложений в другие, так и в случае одновременного развития различных процессов генерации газов.
В водах месторождений, содержащих H2S смешанного состава, есть сульфаты и сульфатредуцирующие бактерии, но количество сероводорода и его и. с. не характерны для зоны активного развития микробиальных процессов; они свидетельствуют о проникновении H2S из близлежащих скоплений высококонцентрированных сернистых газов. Подобного рода H2S был встречен в надсолевых отложениях Прикаспийской впадины, а также в некоторых других регионах. СO2 смешанного генезиса встречен в разрезе палеозойских и базальных горизонтов мезозойских отложений Западной Сибири, где наличие его объясняется не только гидролизом водорастворенных карбонатов, но и образованием СO2 при разложении ОВ и РОВ и водорастворенного ОВ.
Газы смешанного генезиса отличаются пестротой и.с. в зависимости от преобладания той или иной генетической составляющей.
Из вышеизложенного очевидно, что и.с. сероводорода и углекислоты является индикатором их происхождения. Он также может служить критерием для прогнозирования их содержания. Легкий и. с. присущ небольшим концентрациям (H2S не более 3 %, СO2 не более 5 %). Тяжелый и.с. серы и углерода кислых газов дает основание прогнозировать их высококонцентрированные скопления (рис. 1, 2).
Предлагаемые изотопные критерии особенно интересны потому, что изотопный состав углерода и серы свободных и водорастворенных газов практически идентичен. Это дает возможность судить о количестве кислых газов в залежах уже на первых этапах поисково-разведочного бурения независимо от ориентировки скважин относительно самой залежи, характера полученного при опробовании флюида, стабильности притока и т. п.
СПИСОК ЛИТЕРАТУРЫ
1. Анисимов Л.А. Геохимия сероводорода и формирование залежей высокосер- ннстых газов. М., Недра, 1976.
2. Генезис СО2 в нефтяных попутных газах (по изотопному составу углерода) / Р.Г. Панкина, В.Л. Мехтиева, С.М. Гуриева, Е.Н. Шкутник. - Геология нефти и газа, 1978, № 2, с. 38-44.
3. Гриненко В.А., Вдовыкин Г.П. Изотопный состав серы из газонефтяного месторождения Лак (Юго-Западная Франция)- Геохимия, 1966, №3, с. 351-353.
4. Изотопный состав серы сульфатов и сульфидов вод некоторых районов Предкавказья в связи с их генезисом / Р.Г. Панкина, В.Л. Мехтиева, В.А. Гриненко, М.Н. Чурмантеева. -Геохимия, 1966, № 9, с. 1087-1094.
5. Изотопный состав углерода CO2 газов Западной Сибири в связи с его генезисом / С.П. Максимов, Р.Г. Панкина, С.М. Гуриева, Н.П. Запивалов. - Геохимия, 1980, № 7, с. 992-998.
6. Киссин И.Г., Пахомов С.И. О влиянии высоких температур на формирование химического состава подземных вод. - Геохимия, 1967, № 3, с. 341-380.
7. Мехтиева В.Л., Бризанова Л Я. Об абиогенном восстановлении сульфатов в земной коре. - Геология нефти и газа, 1980, № 3, с. 32-39.
8. Панкина Р.Г. Геохимия изотопов серы нефтей и органического вещества. М., Недра, 1978.
9. Панкина Р.Г., Мехтиева В. Л. Изотопный состав серы H2S попутных газов бобриковского горизонта Волго-Уральской области. - Геохимия, 1964, № 9, с. 866- 871.
10. Bottinga J. Calculation of fractionation factors for carbon and oxygen isotopic exchange in the system calcite-carbon. - J. Phys. Chem., 1968, 72, p. 800-808.
11. Krouse H. R. Stable isotope geochemistry of non-hydro-carbon constituents of natural gas. 10th World Petroleum Congress, Bucharest, 1979, Panel discussion, p. 1-7.
12. Toland W. G„ Oxidation of organic compaunds with aqueous sulfate. - J. Am. Chem. Soc., 1960, № 82, p. 19117-19120.
Поступила 14/IV 1981 e.
Рис. 1. Изотопный состав серы H2S разных концентраций в углеводородных скоплениях.
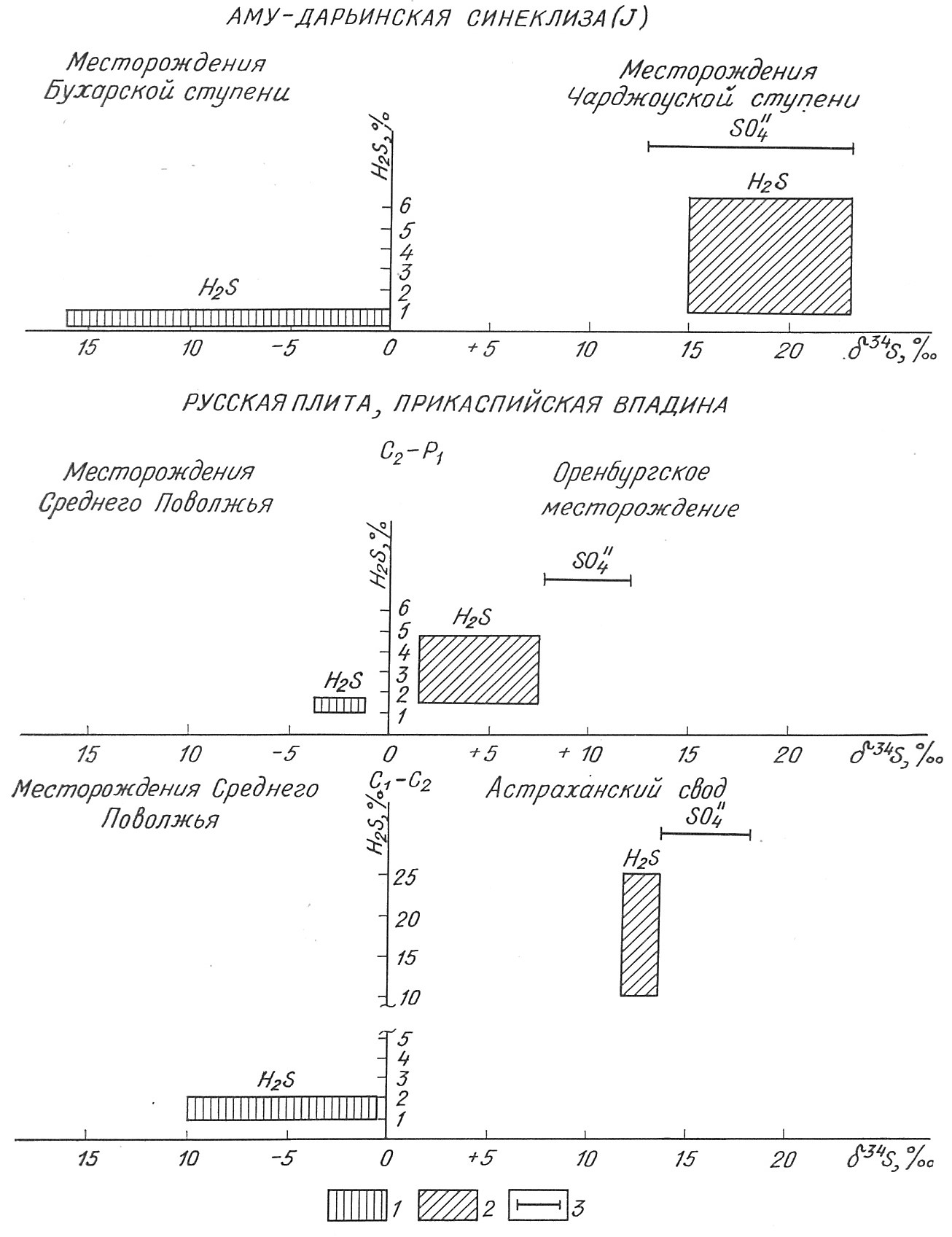
1 - концентрация H2S<2%; 2 - концентрация H2S>2%; 3 - пределы изменения d34S сульфатов
Рис. 2. Изотопный состав углерода СO2 разных концентраций в углеводородных скоплениях.
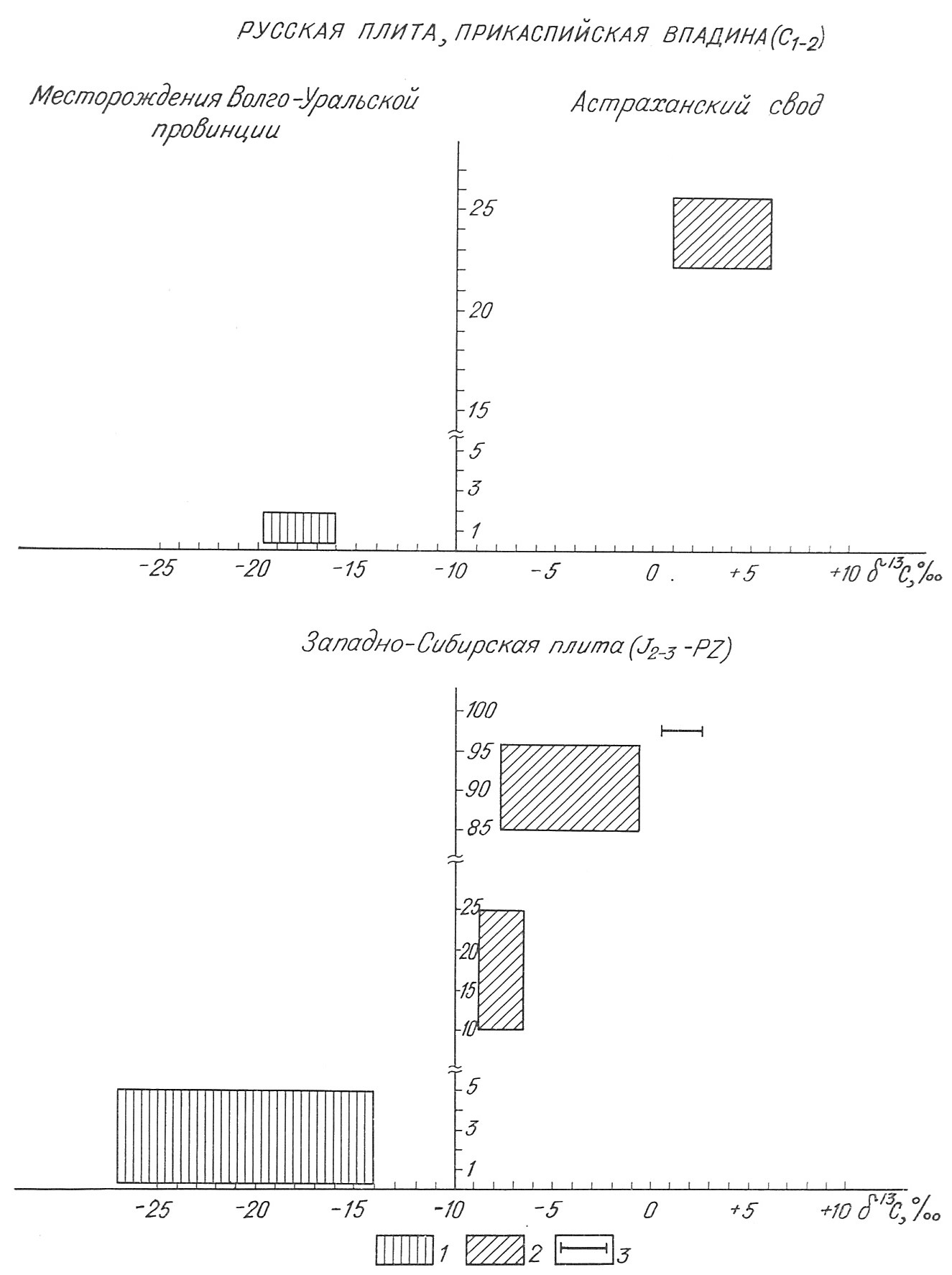
1 - концентрация СO2 <5 %, 2 - концентрация СO2>5 %, 3 - пределы изменений d13С карбонатов